El estudio del
calor y la temperatura, y de las transformaciones asociadas, fue uno de los
temas más fructíferos en el desarrollo del conocimiento científico y
tecnológico del mundo que nos rodea. A partir de él surgieron conceptos
novedosos, tales como la energía, que hoy nos resultan familiares y
fundamentales para comprender fenómenos físicos. Sin embargo, muchos de estos
conceptos no fueron conceptualmente claros durante largo tiempo, ya que no se
los podía relacionar con la estructura de la materia. El descubrimiento del
átomo y su estructura confirmó la hipótesis de que la materia está formada por
partículas. Con este modelo presente, la temperatura y el calor se pudieron
relacionar con lo que ocurre en la materia a escala microscópica.
Termometría y Calorimetría
|
Temperatura (T
o t): a nivel microscópico la temperatura de un cuerpo o sistema está
relacionada con la energía cinética que tienen las moléculas que los
constituyen. Macroscópicamente la temperatura determina el sentido en que se
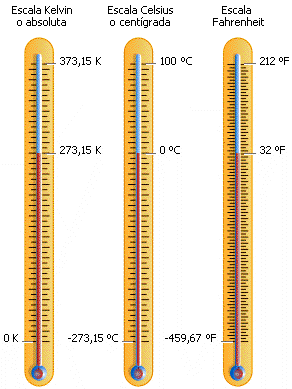
produce el flujo de calor cuando dos cuerpos se ponen en contacto. En el SI la
temperatura se mide el kelvin (K), aunque la escala Centígrados o Celsius (°C)
se utiliza con frecuencia.
Algunas escalas termométricas
Calor
|
El calor (Q)
es la energía transferida de un sistema a otro (o de un sistema a sus
alrededores) debido en general a una diferencia de temperatura entre ellos
(desequilibrio térmico). El calor que absorbe o cede un sistema termodinámico
depende normalmente del tipo de transformación que ha experimentado dicho
sistema. Dos o más cuerpos en contacto que se encuentran a distinta temperatura
alcanzan, pasado un tiempo, el equilibrio térmico (misma temperatura). Este
hecho se conoce como como Principio Cero de la Termodinámica.
Como el calor
es una forma de energía, su unidad de medida en el S.I. es el Joule
(J), sin embargo, en la práctica es común utilizar la caloría para la medición
del calor. Una caloría (cal) es la cantidad de calor necesario
para elevar la temperatura de un gramo de agua pura en 1 °C (desde 14,5 °C a
15,5 °C), a presión atmosférica normal (1 atm).
Como la
caloría es una unidad relativamente pequeña, suele utilizarse una unidad
múltiplo, la kilocaloría: 1 kcal = 1.000 cal
Equivalencias:
una caloría (cal) equivale a 4,1868 julio (J), mientras que una
kilocaloría (kcal) son 4186,8 julios (J).


Calor específico:
Un aspecto del calor que conviene resaltar es que los cuerpos no almacenan calor, sino energía interna. El calor es por tanto la transferencia de parte de esa energía interna de un sistema a otro, con la condición de que ambos se encuentren en desequilibrio térmico. Esta transferencia depende de la masa del cuerpo, del calor específico de dicha sustancia y de la variación de la temperatura (temperatura final menos temperatura inicial).
Donde  es la cantidad de calor (J),
es la cantidad de calor (J),  es la masa del cuerpo (kg),
es la masa del cuerpo (kg),  es el calor específico de la sustancia y
es el calor específico de la sustancia y  es la variación de la temperatura (K).
es la variación de la temperatura (K).
Se define al calor específico como la energía necesaria para elevar en un grado la temperatura de un kilogramo de masa. Su unidad de medida en el S.I. es J/kg.K aunque también suele utilizarse la cal/g.°C
Por ejemplo, si el calor específico del aluminio es 0,220 cal/g.°C, esto significa que un gramo de aluminio necesita una caloría para elevar un grado centígrado su temperatura.
No hay comentarios:
Publicar un comentario